Parche de fibrina
Una estrategia llevada a cabo por nuestro grupo ha sido el uso de pegamento de fibrina como sistema de parches naturales para regenerar el miocardio dañado. La fibrina tiene la capacidad de servir de cola biológica, manteniendo las células juntos en el lugar y estimulando así la angiogénesis, pudiendo ser un buen vehículo para la implantación de células terapéuticas.
En un primer estudio, diseñamos un experimento in vivo en el que se utilizaba cola de fibrina para implantar células madre mesenquimales de sangre de cordón umbilical humano (UCBMSC) marcadas mediante un sistema de imagen de bioluminiscencia no invasiva (BLI) y fluorescencia. BLI permite un seguimiento en tiempo real de la ubicación, proliferación y diferenciación de células que expresan la luciferasa en los tejidos vivos. En primer lugar, marcamos las células con este sistema, las cargamos en un parche de fibrina de tres dimensiones (3-D) y las trasplantamos para cubrir el miocardio dañado en un modelo de ratón inmunodeficiente de infarto de miocardio (MI). Como resultado, las células implantadas mostraron proliferación y diferenciación temprana dentro del parche en los animales postinfartats del grupo MI-UCBMSC. Las células implantadas también participaron en la formación de nueva microvasculatura funcional que conectaban el parche de células de fibrina tanto al tejido de miocardio subyacente como al sistema circulatorio del huesped. Es importante destacar que los animales tratados mejoraron su función cardíaca y mostraron una disminución de la cicatriz de infarto. En resumen, un parche de fibrina diseñado en 3-D formado por UCBMSCs atenuó la disfunción cardíaca derivada de un infarto cuando se trasplantó localmente la herida herida del miocardio.
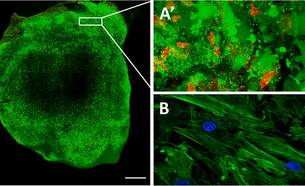
Roura S, Bagó JR, Soler-Botija C, Pujal JM, Gálvez-Montón C, Prat-Vidal C, Llucià-Valldeperas A, Blanco J, Bayes-Genis A. Human umbilical cord blood-derived mesenchymal stem cells promote vascular growth in vivo. PLoS One. 2012;7(11):e49447.
Roura S, Soler-Botija C, Bagó JR, Llucià-Valldeperas A, Férnandez MA, Gálvez-Montón C, Prat-Vidal C, Perea-Gil I, Blanco J, Bayes-Genis A. Postinfarction Functional Recovery Driven by a Three-Dimensional Engineered Fibrin Patch Composed of Human Umbilical Cord Blood-Derived Mesenchymal Stem Cells. Stem Cells Transl Med. 2015 Aug;4(8):956-66.
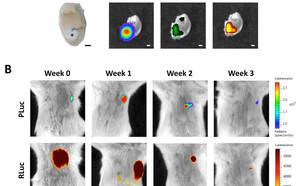
En la misma línea, también trasplantamos células progenitoras derivadas de tejido adiposo cardiaco y subcutáneo humano (ATDPCs) en un parche de fibrina en el modelo de MI de ratón inmunodeficiente. En este caso, nuestro objetivo era supervisar la diferenciación cardiaca y endotelial in vivo de las ATDPC cardíacas a través de BLI. Los niveles de luz se cuantificaron cada semana y los animales fueron sacrificados un mes después de la implantación. La cuantificación inicial de BLI indicaba que la diferenciación cardíaca ya estaba inducida una semana después de la implantación celular en ambos tipos de células, aunque los niveles eran notablemente más altos en las ATDPC cardiacos. La diferenciación endotelial era similar en los ATDPC cardíacos y subcutáneos, aunque las células cardíacas indujeron la formación de vasos con más eficacia. En consecuencia, el tratamiento ATDPC se tradujo en mejoras funcionales y morfológicas detectables en la función cardíaca. Como conclusión, las ATDPC se diferencian a los linajes cardiogénicos y endoteliales cuando se implantan mediante parche de fibrina en un modelo de ratón de IM, siendo las ATDPC cardiacas las que van más fácilmente al linaje cardiogénico que las ATDPC subcutáneos.
Bagó JR, Soler-Botija C, Casaní L, Aguilar E, Alieva M, Rubio N, Bayes-Genis A, Blanco J. Bioluminescence imaging of cardiomyogenic and vascular differentiation of cardiac and subcutaneous adipose tissue-derived progenitor cells in fibrin patches in a myocardium infarct model. Int J Cardiol. 2013 Nov 15;169(4):288-95.
Para mejorar aún más el uso de las ATDPC cardiacas con fines de regeneración cardíaca, hemos desarrollado un dispositivo que acondiciona electromecánicamente estas células en colaboración con el equipo del Dr. Bragós (Universidad Politécnica de Cataluña). Se planteó la hipótesis de que los estímulos electromecánicos in vitro podrían beneficiar la integración y la retención de células en el corazón. Una vez estimuladas las células electromecánicas, se etiquetaron con fluorescencia, embebidas en la cola de fibrina y se implantaron en el área infartada del corazón del ratón. El acondicionamiento electromecánico de las células promovió un fenotipo similar a un cardiogénico in vitro, que provocó la recuperación de la función cardíaca y el aumento de la densidad de los vasos en la región fronteriza de infarto cuando se probó en el modelo de ratón. Las células entrenadas dentro del parche de fibrina implantado migraron al tejido infartado subyacente. Para concluir, el acondicionamiento electro-mecánico síncrono de las células antes de la implantación puede ser una alternativa preferible cuando se consideran estrategias para la reparación del corazón después del infarto de miocardio.
Llucià-Valldeperas A, Soler-Botija C, Gálvez-Montón C, Roura S, Prat-Vidal C, Perea-Gil I, Sanchez B, Bragos R, Vunjak-Novakovic G, Bayes-Genis A. Electromechanical Conditioning of Adult Progenitor Cells Improves Recovery of Cardiac Function After Myocardial Infarction. Stem Cells Transl Med. 2017 Mar;6(3):970-981.

A pesar de la importancia de nuestros resultados utilizando el parche de fibrina como vehículo de células terapéuticas y la diferenciación celular en el tejido huésped, la regeneración completa de los órganos no se consiguió. Esto sugiere la necesidad de plataformas terapéuticas más sofisticadas que limiten la propagación de la zona infartada y eviten la remodelación excesiva del ventrículo.